新聞畫面偶爾會傳出現誤用科學玩具的消息,像這一類的偶發事件,通常操作者以不恰當且不被允許的方式,也就是誤用了物質的變化過程當作是開玩笑的工具,但開玩笑的結果往往形成不可逆的身心傷害,而且加害者往往不能承擔這嚴重的後果。
孩童最喜歡的爆裂聲響是自脹氣球,也就是俗稱炸彈包的賣點之一,但它是不是真的爆炸,其實並非如此。它的內部反應不是劇烈的氧化還原,而是簡易的酸鹼中和。為什麼原本穩定的內部化學物質會發生反應,並且會產生氣體使得壓力變大而膨脹?讓我們共同來一窺其中奧妙。

不論是左邊的炸彈包還是右邊的放屁包,都是利用容易且迅速發生的化學反應
首先準備好自脹氣球,先觀察它的物理性質,像是包裝外觀、形式以及內容物的狀態等等,也可以先閱讀使用說明及注意事項之後再開始進行下一步。從外觀包裝形式可以得知反應前是一個密閉系統,透過搖晃的動作可以聽到沙沙的聲音,也能猜測得到裡面有固體粉末。用手感覺後,也發現裡面有一包液體。

說明雖不算詳細,但簡單的圖示可以讓人按圖索驥
除了玩法以外,更重要的是找出它的成份標示


不是自誇,真的是要外銷到日本的MIT台灣產品標示才符合規範
明確地標示出參與反應的內容物成份為「碳酸氫鈉」以及「檸檬酸」
在尚未發生化學反應而膨脹的自脹氣球包裝上,用剪刀小心地剪裁出一個缺口,將裡面的內容物倒出來。觀察內容物的物理性質(顏色及狀態),並使用溫度計測量其原本的溫度。

準備好以上的工具,因為我們不是單純的玩
而是要認識裡面的物質、反應與能量進出

實驗當時的室溫為攝氏20度

內容物取出後,可以發現白色粉末與透明液體,透過塑膠包裝將兩者隔開
應先觀察,而不是急著將兩者混合在一起實驗
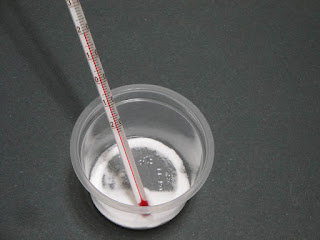

做實驗之前,先量測內容物的初溫,也剛剛好是攝氏20度
其實在長時間的熱平衡後,室溫與各物體的溫度應該是一致的才是
將內容物混雜在一起,即可發生化學反應,因為液體的檸檬酸水溶液提供了絕佳的反應環境。進行變化的期間,可再將溫度計置入正在反應的混合物中,測量反應過程中的溫度變化。

猜猜看怎麼著?溫度下降得非常迅速
以這麼少量的反應物來說,降溫的效果真的很不錯
在這個實驗中的反應是屬於酸性物質(檸檬酸)和鹽類(碳酸氫鈉)的反應。透明液體是檸檬酸,屬於弱酸性化合物;而白色粉狀的鹽類則是常見的小蘇打,屬於弱鹼性的鹽類。因此整個過程也可以看成是弱酸與弱鹼的酸鹼中和反應。
化學變化的過程中,會產生出與原本反應物物理性質及化學性質截然不同的生成物。反應發生時,產生的氣體為二氧化碳,可利用燃燒中的火柴或澄清石灰水來檢驗。如果是依正常步驟使用自脹氣球,氣體的產生會使內部壓力增加,密閉的包裝因此逐漸膨脹,最後內外壓力不平衡且封口處承受不了後,就會導致爆裂。炸裂時會伴隨著驚人的聲響,可以吸引眾人的目光,可說是教師介紹鹽類物質時的最佳幫手。
曾經聽聞有國中老師提出這樣的想法:溫度下降是不是因為「絕熱膨脹」的關係?我只能說這是「天大的誤會」,內心在猜這會不會是地球科學老師提出的問題。因為並不是有氣體產生並散出而且溫度下降時,就會跟絕熱膨脹扯上關係。即便是有,少量的氣體對於溫度下降的影響也不大,況且還有水的存在。更何況在捏破裝有檸檬酸水溶液的內袋時,溫度就已經開始快速下降了,如果你願意也夠有勇氣,可以在捏破內袋後拿在手上幾秒鐘感覺一下,就應該能明白絕熱膨脹不是溫度下降的主要原因。
所以我才在玩自脹氣球之外加入了溫度計作為輔助。在反應發生時,會讓人驚訝地發現到這兩種材料(弱酸與弱鹼)中和時,系統的整體溫度是逐漸下降的。不過這並不代表老師在課堂上講的不正確,酸鹼中和的確是放熱反應,但同時要考慮到碳酸氫鈉(鹽類)在溶解於水的過程中所吸收的大量熱量,這比中和過程所放出的熱量可是要大上很多的呢!

說著說著,不知不覺間又下降了2.5度,來到攝氏13.5度,多麼令人驚奇
這樣就結束了嗎?其實讓反應物充分反應,就可以降得更低
如果手邊沒有溫度計,可以將它們放在你的手上反應,親自感覺一下溫度的變化所帶來的清涼感!底下附上這個反應中所發生的反應式以及熱量進出的始末,大家可以參考看看(資料來源:俞岳川教授)。
溶解熱
中和熱
H3O+(aq) + OH-(aq) → 2H2O(l) ,ΔH=-55.90KJ/mol(放熱)
H3O+(aq) + OH-(aq) → 2H2O(l) ,ΔH=-55.90KJ/mol(放熱)
H3O+(aq) + HCO3-(aq) →
H2O(l) + CO2(g) ,ΔH=-11.77KJ/mol(放熱)
0 -691.11 -285.84 -393.5
NaHCO3(s) + H2O(l) →
Na+(aq) + HCO3-(aq) ,ΔH=+16.93KJ/mol(吸熱)
-947.7 -239.66 -691.11
沒有留言:
張貼留言